曾获雷军加持现成妖股 董事长被监管谈话,九安医疗信披不完全
天津证监局直指九安医疗披露信息不完全
此前连续大涨而被市场视为妖股的九安医疗(002432.SZ),再受监管关注。
2月14日晚间,九安医疗发布公告称,近日收到天津证监局下发的《行政监管措施决定书》和《关于对刘毅、邬彤采取监管谈话措施的决定》(下称《决定》),要求刘毅、邬彤在2月18日前至天津证监局接受监管谈话。刘毅为九安医疗董事长、总经理,邬彤为董事会秘书。
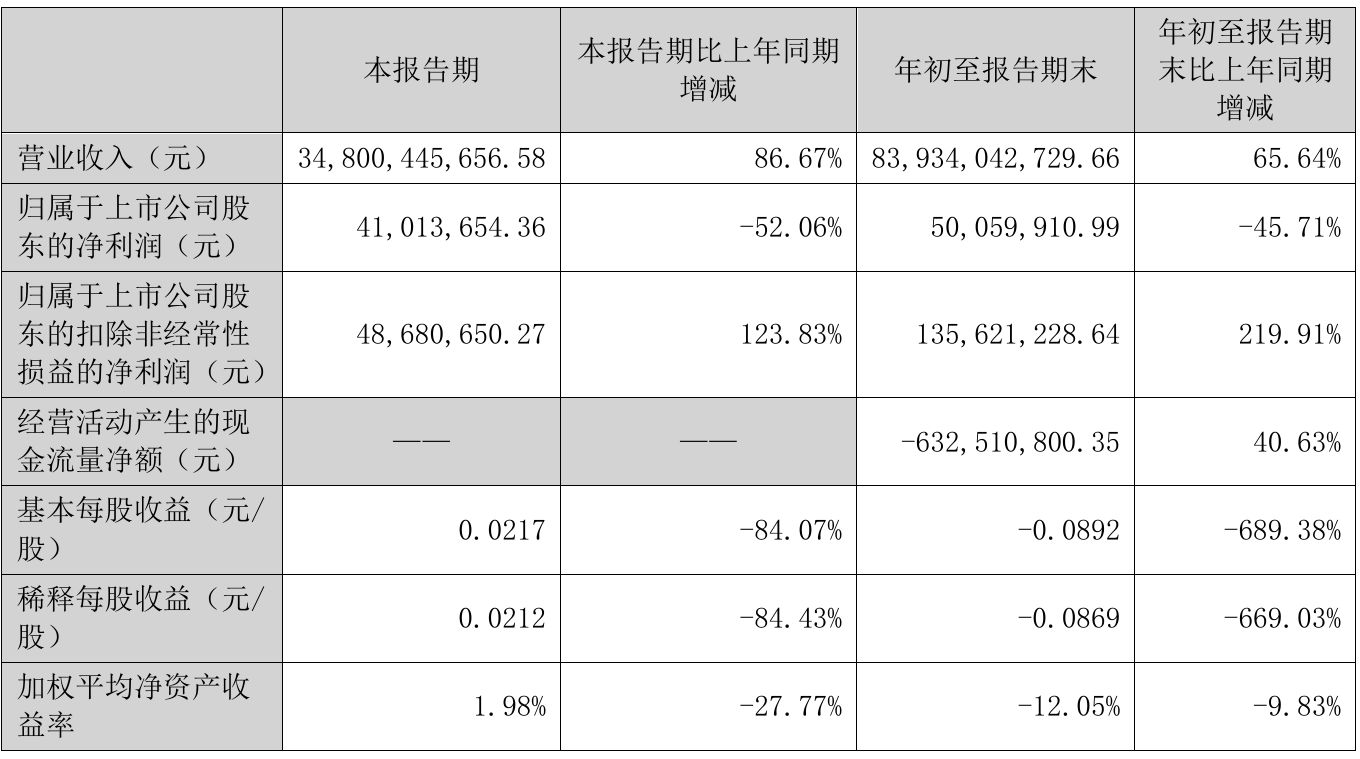
日前,九安医疗发布2021年度业绩预告。报告期内,公司净利润9亿元至12亿元,同比上涨271.4%至395.19%。九安医疗自带光环,是市场热捧的“小米概念股”和“苹果概念股”。2010年,九安医疗创建自主创新品牌iHealth,推出与苹果手机相连的移动互联血压计,得到美国苹果公司大力支持,进入苹果公司线上官网和线下直营渠道。此后,九安医疗还获得小米科技2500万美元战略投资,成为小米生态链合作伙伴。
据九安医疗官网,2017年9月,iHealth额温计在小米夏季新品发布会上正式首发,雷军推荐它是“为发烧而生的体温计,居家旅行必备”。
2020年之后,九安医疗又成为新冠检测概念股。该公司表示,2021年度继续受全球新冠疫情影响,公司的新型冠状病毒(SARS-CoV-2)抗原家用自测OTC试剂盒产品在美国市场销售业绩大幅增长,促使2021年度经营业绩大幅增长。
近期,九安医疗股价连续调整。自1月18日至2月14日,它的股价从最高88.88元/股下跌至58元/股,累计下跌34.7%。2月15日,九安医疗早盘低开54.75元/股,盘中最高涨至56.5元/股,总市值267.54亿元。
信披不完全
《决定》所指之事,源于2022年初的一场实验结果披露。2022年1月7日,九安医疗发布公告称,已收到美国FDA安排的iHealth新冠抗原家用自测OTC试剂盒(下称“iHealth试剂盒”)对奥密克戎(Omicron)变异病毒的测试性能实验报告,在实验中100%的检测出了最大CT值为21.59(n=5)的奥密克戎活性病毒样本。
因其未披露CT值大于21.59的样本测试结果,深交所置疑其存在选择性披露部分信息以炒作股价的情形,于1月12日下发关注函。
1月15日,九安医疗回复关注函表示,“最大”的含义代表小于等于21.59的样本可以100%检出,大于21.59的样本无法100%检出。同时披露该实验全部实验组样本阳性检出率:“CT值≤21.59 时可全部检出,CT 值 22.86 时可 60%检出,CT 值≥23.87 时完全不能检出。”
随后,天津证监局下发的《决定》,直指九安医疗披露信息不完全:刘毅作为九安医疗董事长兼总经理,邬彤作为九安医疗董事会秘书,对上市公司临时报告信息披露的完整性承担主要责任。二人在任职期间,未能忠实、勤勉地履行职责,违反了《上市公司信息披露管理办法》第四条规定,天津证监局决定对二人采取监管谈话的监督管理措施。
天津证监局要求九安医疗及相关人员按照监管要求积极整改,吸取教训,加强内部控制和信息披露管理,切实提高公司规范运作水平和信息披露质量,维护公司及全体股东利益。
九安医疗是一家研发健康电子产品和搭建个人健康管理平台的企业,但是嫁接互联网的九安医疗近几年在二级市场上的表现并不出彩。
直至2021年11月8日,九安医疗发布公告称iHealth试剂盒获美国食品药品监督管理局(FDA)应急使用授权(EUA),可在美国和认可美国EUA的国家或地区销售,股价一度累计上涨超十倍。
海外新冠确诊病例数持续攀升,新冠检测需求激增。安信证券曾分析指出,考虑到美国目前是全球新冠检测增量最为庞大的市场、雅培等本土品牌出现断货、获批FDA(EUA)的中国厂商较少、美国作为主权国家各地防疫政策法规及市场环境相对统一等因素,已经在美国获批或即将获批的中国厂商,有望在这一轮疫情中收获可观的业绩弹性。
新冠自测产品海外受追捧
新冠检测方法主要包括抗体检测、核酸检测和抗原检测。其中,抗原检测可在家自测,15至30分钟即可得到结果,成本较低,欧美等海外国家广泛采用抗原自测。
据时代周报记者初步统计,全球获得美国食品药品监督管理局(FDA)紧急使用授权(EUA)的新冠检测抗原试剂盒的公司有13家。
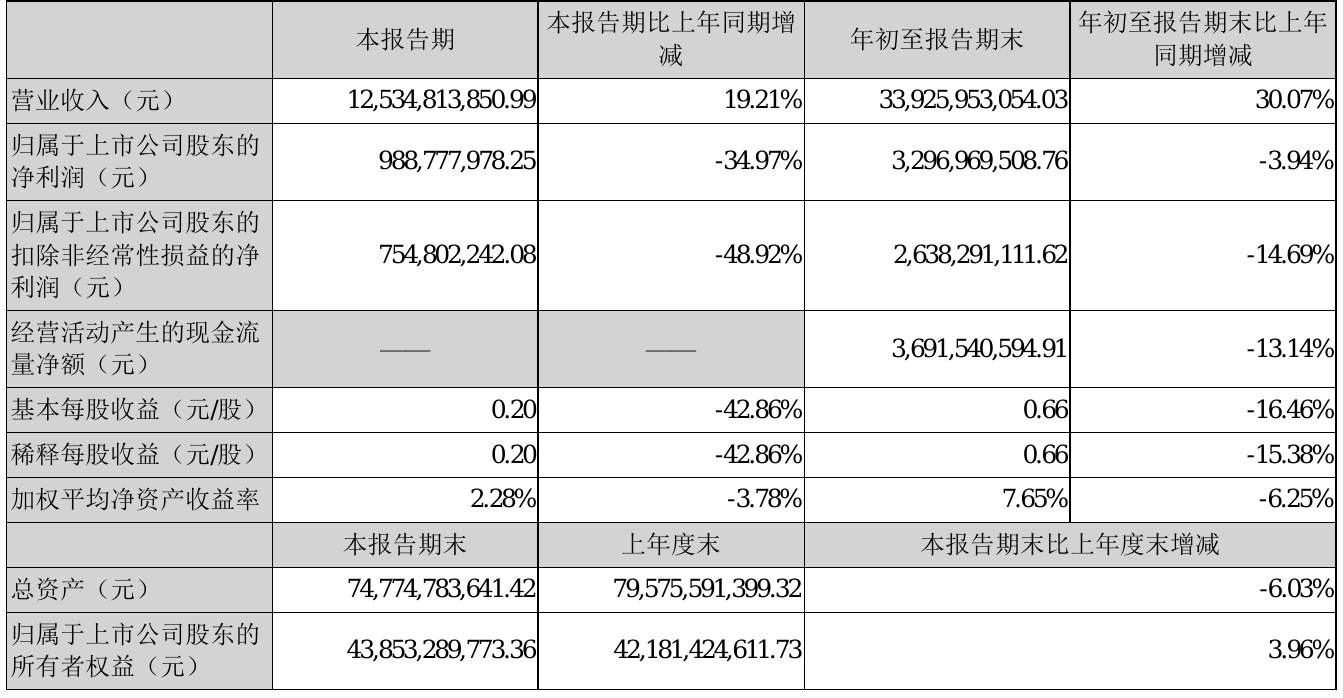
此前,九安医疗已在美国斩获大额订单。1月13日,九安医疗公告称,美国子公司(iHealth Labs. Inc)与纽约州卫生部签订采购iHealth试剂盒的订单,累计订单金额约11.8亿元,与美国马萨诸塞联邦及该州卫生与公众服务部执行办公室订单累计金额超9.4亿元。
此外,美国子公司与美国陆军合约管理指挥部于当地时间1月13日签署iHealth试剂盒采购合同,合同价税合计超81亿元,并于当地时间1月26日追加采购,合同价税增加至超112亿元。
2月14日晚间,九安医疗披露的投资者关系活动记录表显示,通过近几个月iHealth试剂盒产品在美国市场的销售,公司的iHealth品牌成为美国的主流品牌。根据已披露的美国政府采购订单情况,公司获取了第一次5亿人份试剂盒采购合同中70%左右的份额。目前,第二批5亿人份试剂盒的招标信息已在美国政府官方采购公示网站公布。
“公司在排产高峰期的商业订单交货周期是6至8周,目前交货排期有所缩短。根据目前的排产计划,即将可以按计划满足政府和商业客户的需求。”投资者关系活动记录表披露。
除九安医疗,国内还有东方生物(688298.SH)和艾康生物两家公司生产的新冠抗原自测试剂能进入美国市场。2月7日,安图生物(603658.SH)也在投资者互动平台上表示公司抗原自测检测项目通过FDA(EUA)快速审批通道。
此外,国内多家生产新冠抗原自测试剂盒的企业陆续攻占美国以外的海外市场。华大基因(300676.SZ)和华盛昌(002980.SZ)分别于近日表示新冠抗原自测产品获得欧盟CE认证。2月11日,亚辉龙(688575.SH)收到日本株式会社医学生物学研究所(MBL)的抗原检测试剂盒订单,金额价税合计约3.4亿元。
安信证券此前表示,随着奥密克戎毒株的迅速传播、美国进一步推广家庭自检产品以及1月即将到来的春季学期,都将持续刺激新冠检测的需求。
基于对未来行业趋势的判断,预计2022年欧洲、美国合计新冠检测市场规模有望达到33.91亿美元,折合人民币约220亿元。
标签:
您可能也感兴趣:
为您推荐
国海证券:监事蒋曼萍辞职
东华能源:邵勇健辞去董事、副总经理等职务
中国海油集中签约12家国际公司 合作金额逾130亿美元
排行
精彩推送
- 曾获雷军加持现成妖股 董事长被监管谈话,九安医疗信披不完全
- 员工混用、供应商重叠、涉嫌股权代持,涛涛车业遭暂缓审核
- 卖身失败转战IPO,业绩颓势已现,大客户频繁流失,信邦智能经...
- 鸿博股份扣非连亏四年谋并购转型 标的盈转亏4991万业绩承诺缩水20%
- 一汽解放销量骤降逾64%进入存量竞争 胡汉杰直言“卖车难盈利...
- 赛道股强势回归 A股反复磨底
- V观财报|华谊兄弟:王忠磊减持300000股
- 要把川渝麻辣烫做上市的,竟然是个东北人儿
- 新年首家券商反洗钱处罚:中天证券被罚137万元
- 金地集团:2021年净利润94.6亿元 同比下降9%
- 黑猫、白猫不接受新车订单?欧拉品牌回应:两款车型已停产
- 冬季续航缩水被罚!特斯拉在韩国“碰钉子”,电动车续航问题...
- 上海建工:法院裁定查封冻结或扣押恒大成都心怡房产6.4亿元财产
- 活跃司机数量下降 快狗打车如何破解同质化竞争难题?
- 星源材质再收深交所问询函 环评审批问题受关注
- 金地集团2021年实现净利润94.63亿元 同比下降8.99%
- 明星“跳单”之后:房产中介收费模式再陷舆论旋涡
- “快递一哥”预告业绩降幅40%,行业洗牌是否到来?
- 正荣地产:集团营运仍属正常,继续照常开展业务
- 宁德时代荣誉董事长张毓捷因病逝世,动力电池巨头未来驶向何方?
- 青海下拨3400万元农业生产救灾资金
- 国海证券:监事蒋曼萍辞职
- 东华能源:邵勇健辞去董事、副总经理等职务
- 中国海油集中签约12家国际公司 合作金额逾130亿美元
- 社区团购战火烧到快递业 多多买菜欲分食“最后一公里”胜算...
- 减税降费助提北京冬奥会科技含量
- 金地集团2021年营收992.32亿元 同比增长18.16%
- 华润置地1月实现销售额152.6亿元 同比减少37.0%
- 金辉控股1月实现销售额43.2亿元 销售面积27.5万㎡
- 金科股份拟公开发行不超15亿元公司债券
- “多彩环线”串起川渝黔 中国高铁服务走向“品牌化”
- RCEP实施首月 福建产业对日出口利好明显
- 东西双塔成功“牵手” 深中通道伶仃洋大桥先导索过江
- 瑞雪中的一抹亮色
- 数字经济“点亮”江西别样元宵 营商环境“催生”赣鄱风景独好
- 为支持公司发展,森马服饰实控人转让公司股票给公司高管
- 国海证券:监事蒋曼萍辞职
- 东华能源:邵勇健辞去董事、副总经理等职务
- V观财报|金地集团业绩快报:2021年净利同比降8.99%
- V观财报|杭锅股份:自2月16日起证券简称变更为“西子洁能”
- V观财报|东方电缆:中标合计13.9亿元海上风电海缆总包项目
- V观财报|淮北矿业:15.22亿股限售股将于2月21日解禁上市
- V观财报|兖矿能源:独董田会因昊华能源信披违规事项遭罚
- V观财报|欢瑞世纪:来源于《十年一品温如言》的营收约为400万元
- V观财报|重庆百货:子公司拟参与经营Smart品牌新能源车业务
- 新春开年启新程 百利好携手智库直播 惊喜好礼送不停
- 张艺谋的XR公司再获融资 元宇宙究竟是谁的解药?
- 甬矽电子2月22日科创板首发上会
- 青海春天的新故事:经太上老君“点化” 的听花酒5.86万一瓶...
- 江淮汽车主业5年巨亏50亿 蔚来意外爆冷代工业务承压
- 港股市场连续第三天下跌 金融股周期股回调 CXO强势上涨
- 恒生公司拟推出全新中国指数 恒生中企指数基础上纳入A股公司
- 上市猪企2022首月成绩单:傲农生物股价与销量“齐飞” 猪价...
- 高铁上的元宵灯会
- 迎春战雪保障冬奥列车通畅
- 谷爱凌摘银后想吃芝麻味元宵 今年“元宵经济”有了新的消费趋势
- 国货弄“潮” 抢驻中国“Z世代”化妆包
- “网红小吃”螺蛳粉牵手直播新业态春节“不打烊”
- 南渔北移 黑龙江省去年渔业产值135亿元
- 上架爆火到主动下架,啫喱用了3周
- 杀猪盘!抖音“大V”忽悠荐股,东方能源怒怼“三无报道”“小...
- 蔚来回应“蔚来汽车科技公司注销”:对业务没影响
- 深信服令人难信服:“监控门”被曝光无回应,业务单一暴露业...
- 中信特钢跌3.7% 海通证券在其高点唱多
- 候车厅里元宵暖
- 深圳宝安邮政快递企业停止入境邮件快件上门派送业务
- 辽宁省就业工作实现开门红同比增幅100.5% 完成年度目标10.1%
- 车厘子价格“跳水” “甩尾”迎接大樱桃上市
- 茅台集团董事长丁雄军:市场人员要到线上去、到“茅粉”中去
- 金地集团2021年业绩快报:结算规模和毛利率不及预期 归母净...
- 中信特钢跌3.7% 海通证券在其高点唱多
- 来伊份再遭大股东减持,股价已连续5个交易日下跌,2021年扣非...
- 宁德时代起诉蜂巢能源不正当竞争,后者刚启动IPO辅导不久
- 上交所问出恩怨情仇?长电科技和甬矽电子对簿公堂
- 保时捷任命 Michael Kirsch 接任中国总裁及首席执行官
- 传销嫌疑未清,张庭夫妻再成立新公司
- 成本压力难转嫁,赊销模式难持续,创维电器“押注”ODM进退维谷
- 舍得酒业营销公司原总经理吴健入职贵州醇 担任销售负责人岗位
- 药明康德业绩快报:2021年净利润同比增长72.19%
- 2022年1月共计154.26万辆汽车被召回 包括奥迪、奔驰等
- 多家房企半月内发短债拟募资44亿元 资金压力依然严峻
- 2月15日国内原油期货涨1.94%
- A股28家房地产相关企业去年合计预亏超790亿元 降价、计提减...
- 收评:创指高开高走大涨3.09% 赛道股卷土重来
- 坤恒顺维上市首日涨11% IPO募资7.1亿前年营收1.3亿
- 人民银行开展3000亿元MLF操作 增量续做维护流动性合理充裕
- 阳光城及其母公司已处置20余项优质资产 累计偿还债务超450亿元
- 九安医疗董事长刘毅和董秘邬彤被监管谈话 股价涨3.2%
- 泛海控股回复关注函:减值准备确认与经营情况变化切实相关
- 鸿博股份定增或存实质性障碍 股权激励疑为高管发红包
- 吉药控股“乱局”:新老东家“撕破脸” 重大资产出售或“生变”
- 日跌66%市值蒸发超百亿!正荣地产遭遇黑色星期五后股价续跌15%
- 溢价2087%搞收购!上市不满半年君亭酒店火速变更募资用途
- 资产负债率80%!ODM业务提升反手拉低毛利率,创维电器IPO悬念待解
- 东软教育2021年利润预计同比增长不少于190% 在校生及平均学...
- 十问紫燕食品:是否虚增营业收入?是否涉嫌虚假陈述?
- 和讯SGI公司|紫晶存储和讯SGI评分为55!被证监会立案调查,净...
- 英威腾业绩快报看点:营收高增长下四季度净利润表现尴尬
- 腾讯诉“5G芝麻”平台预装《英雄联盟》等游戏获赔88万
- 趣店收纽交所“退市”警告函,罗敏千亿市值梦至面临退市仅4年



 营业执照公示信息
营业执照公示信息