恒瑞医药注资企业新药上市申请遭拒 公司回应
中新经纬12月2日电(王玉玲)美东时间12月1日,万春医药宣布收到美国食品和药物管理局(FDA)新药申请(NDA)完整回应函(CRL),回应函显示,万春医药的普那布林(plinabulin)目前临床试验结果不足以支撑有效性。受此消息影响,截至当日美股收盘,万春医药股价暴跌61.39%,报每股4.93美元。
根据回应函,FDA已经完成对普那布林和粒细胞集落因子(G-CSF)联合应用于预防化疗引起的中性粒细胞减少症(CIN)的审查,FDA认为,仅单一注册实验不足以说明普那布林的临床价值,还需要二次进行对照注册临床研究来提供充分的证据支持。
2021年8月25日,江苏恒瑞医药股份有限公司(以下简称恒瑞医药)与大连万春布林医药有限公司(下称大连万春,为万春医药子公司)签署《增资入股协议》和《普那布林产品合作协议》,恒瑞医药拟以自筹资金入股大连万春,并获得在大中华地区的联合开发及独家商业化普那布林的权益,并支付总计不超过13亿元(人民币,如无说明,下同))的首付款和里程碑款。
12月2日,恒瑞医药发布公告称,公司尚未开展任何关于普那布林的临床研究,关于《增资入股协议》所约定的拟向大连万春进行的1亿元股权投资,公司尚未缴款,股权也未交割。关于产品后续研发计划以及合作事项,双方近期将进一步协商。
截至发稿,恒瑞医药跌2.48%,报每股49.25元。
根据公开资料,万春医药是一家成立于2010年的位于临床阶段的生物制药公司。普那布林是万春医药开发的First-In-Class新药,是一种选择性免疫调节微管结合剂(SIMBA),能够用于预防化疗引起的中性粒细胞减少症(CIN)以及治疗晚期非小细胞肺癌(NSCLC)和其他实体瘤的临床开发。
2020年6月,万春医药宣布普那布林用于化疗引起的重度中性粒细胞减少症(CIN)的PROTECTIVE-2III期临床试验中期分析达到主要研究终点,之后,普那布林又相继获得NMPA、FDA突破性疗法认定,此次审核,本应是普那布林商业化进程的“临门一脚”。根据万春医药2020年年报,万春医药所有产品均暂未实现商业化。(中新经纬APP)
您可能也感兴趣:
为您推荐
沪江材料将于1月18日上市北交所 公开发行价为18.68元/股
韦尔股份控股股东虞仁荣质押230万股 质押期限至2023年1月16日
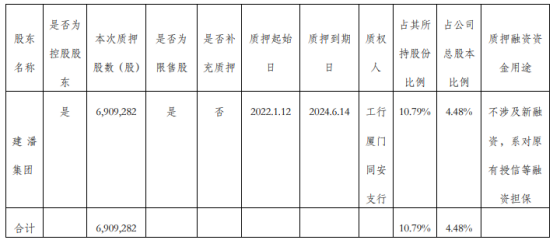
金牌厨柜控股股东建潘集团质押690.93万股 质押期限至2024年6月14日
排行
精彩推送
- 银行板块持续走强 多因素促估值修复
- 华谊腾讯娱乐:CEO袁海波失联不实,股票今日复牌
- 信息披露多次违规,华铁应急遭上交所监管警示
- 或有“戴帽”风险!獐子岛预告扣非净利润持续亏损
- 传祥生实业账户及旗下子公司股权被冻结,祥生方面回应银柿记者
- 进军换电的宁德时代,能否一统江湖?
- 趁着股价四连板“东风”,海量数据实控人忙着减持
- 长春高新连续跌停,控股股东部分质押突破此前平仓线,葛兰或...
- CRO高景气度持续,昭衍新药2021年净利预增,股价却跌跌不休
- 消息称字节跳动2021年或日均进账10.07亿元,但同比增速放缓
- 华润万象生活:拟收购南通长乐全部股权及江苏中南1%股权
- 报告期内因产品抽检不合格被通报 沃文特产品质量问题受关注
- 格兰尼冲刺创业板IPO存偿债风险
- 中恒宠物主要业绩增长稳健 IPO报告期内境外收入较高
- “哔嗨啤”啤酒被曝涉嫌传销,王老吉授权品牌惹火上身
- *ST华塑“抢发”年报保壳收问询,闪电并购的公司撑起8成营收...
- 天有教育上市招股书失效,去年前七个月总营收2.45亿元
- 小红书治理虚假种草 医美连锁品牌“广州曙光医学美容医院”...
- 小红书治理虚假种草 医美连锁品牌“海峡整形”被平台封禁
- 小红书治理虚假种草 日本美容品牌“佑天兰”被平台封禁
- 建发房产待偿还直接债务融资352亿元 拟发行中票部分募资用于并购
- 因为印章,真视通闹了小半年,终于恢复正常使用了!
- 长春高新连续两日跌停,股民人均浮亏13万,发生了啥?
- 瑞幸咖啡否认重回纳斯达克 业内人士称仍存诸多障碍需要“漫...
- 与“果链”深度捆绑的兴禾股份:需求下滑致营收净利双双骤减...
- 德盈控股对赌压力下曲折上市 营收增长乏力高度依赖B.Duck小黄鸭
- 小红书治理虚假种草 德国乳制品品牌“欧德堡”遭平台封禁
- 湖南鑫和医药虚开增值税发票1817万 被罚50万元
- 小红书治理虚假种草 网红民宿酒店安隅、渝舍印象、听花堂、I...
- 中科环保、BYD半导、工大科雅1月27日创业板首发上会
- 芯龙技术1月27日科创板首发上会
- 未按规定披露关联方及关联交易 ST华钰遭处罚
- V观财报|白云机场:2021年预亏约3.8亿-4.7亿
- V观财报|创力集团:董事长石华辉辞职
- 子公司失控后中嘉博创回函:不存在财务“大洗澡”
- V观财报|獐子岛:2021年净利同比预降39%-60%
- 年审报告存虚假记载!中天运被暂停债务融资工具相关业务
- 投诉量超6000条,新老IP交替明显!股价走低泡泡玛特如何破局?
- 净利润增速首次下探!保利发展频繁融资溢价拿地为哪般?
- 恒泰证券原营业部负责人“搞副业”,大连证监局对其出具警示函
- 14批次化妆品被检出禁用原料 涉及广州碧婷化妆品等企业
- 长春高新连续两日跌停 生长激素纳入集采价格或下降70%
- 小红书治理虚假种草 日本保温杯品牌“GERM格沵”遭平台封禁
- “韩束、一叶子”母公司上美集团冲击港交所 近三年营销开支...
- 百世集团因交通事故新增被执行人 执行标的127.74万元
- 权健新增3条被执行人信息 执行金额156.50万元
- 苏大维格实控人陈林森收监管函 敏感期交易自家股票
- 雅本化学收监管函 被问信披是否误导及配合股东减持
- 麦田房产经纪1天收2罚单 为禁止交易房屋提供经纪服务
- 当“织布机”变成“断魂刀”,一场万亿成交下的存量博弈
- 三安光电股价3连阴 海通证券安信证券高点唱多
- 足力健新增被执行信息 执行标的为128万元
- 任泽平与东吴证券属编外合作?以独立学者身份发表观点不代表...
- 华夏航空:副总裁崔新宇辞职
- 嘉化能源:牛瑛山辞去副总经理职务
- 盐湖股份去年净利预增90%-110% 股价今跌7.58%
- 提价效果不佳 生活用纸业持续承压 厂商大笔回购难解困境
- 方正证券去年净利预增50%-70% 股价今涨0.64%
- 盐津铺子实控人等增持仅完成25%就喊停 股价跌2.18%
- 博盈特焊募投项目或存“注水”发行人律师合伙人辞职后任公司董秘
- 写“差评”被判侵权考研机构续:一被告称其知乎账号是他人在用
- 高德联合清华大学发布报告显示:贫困地区经济民生因路而兴
- 联创股份跌13.98% 万联证券高位喊买入
- 1月19日(周三)港股沽空数据出炉 正荣地产沽空比率居首位
- 万达楼盘大门脱落,砸死代驾小哥
- 万人请辞策划冲上热搜一!哈利波特手游道歉,啥情况?
- 网红书店西西弗销售无3C认证儿童商品被罚
- ST起步说明变更会计师事务所相关情况
- 杜嘉班纳违法开除员工判赔36万元
- 网易旗下《哈利波特:魔法觉醒》手游因春节活动引争议,回应...
- 青客租房申请破产清算,此前未履行金额近3000万元
- 安徽建工开年三次成被执行人:去年累计至少4次被列为被执行人...
- 既然有周期,那就有盈亏!”猪茅”净利大滑坡,猪养的到底咋样?
- 小红书起诉4家涉虚假种草通告平台、MCN机构:索赔1000万
- 帝欧家居澄清:欧神诺仍为公司控股子公司
- 诚达药业登陆深交所创业板
- 紫燕食品冲击IPO:年营收超26亿华东贡献超7成,关联销售总额达16亿
- 瑞思教育,再无丰年?
- 三问森马:卖啥?谁卖?咋卖?
- 瑞幸否认重回纳斯达克上市传闻:报道不实
- 阿里文娱退出优酷股东,改由其子公司土豆网络全资持股
- 有赞被爆裁员,官方暂未回应
- 安踏品牌2021年零售金额同比增长25-30%,FILA“显疲态”连续...
- 得利斯诉Yolarno案获法官支持判决,有权追讨600万澳元收购预付款
- 生长激素纳入集采,“生长茅”长春高新闪崩跌停,安科生物大跌7%
- 转型初期多位高管来自竞争对手杉杉,后期业绩靠宁德时代一飞...
- 孩子王预计全年净利润1.96-2.35亿元,同比下滑40%-50%
- 特斯拉霸主地位不保?美银:2024年美国市占率仅为19%
- 两年未融资、扩张失序 钱大妈面临“囚徒困境”
- “女鞋第一股”告别女鞋业务,预亏超4亿的星期六还能好吗?
- 搭上NFT的快车 多次“跨界”的吉宏股份能走多远?
- 港股餐饮板块齐嗨 九毛九涨幅超6% 多家投行看好公司前景
- 永清环保净利预增超1倍 公司称双碳服务将成重点方向
- 伽玛刀进藏! 西部大棋局又拱一卒
- 百年人寿泉州本部营业区开展“苏垵养老院公益活动”
- 医疗版块遭遇黑天鹅,进入调整期
- 美股周三收跌 汇丰银行预计美股全年回报将十分微薄
- 今日上市:诚达药业
- 福安药业超1亿股权转让首期款未收回 研发进入“收获期”账面...
- 汉得信息会计核算调整致净利预增2倍 扣非连亏三季研发费不降...





 营业执照公示信息
营业执照公示信息